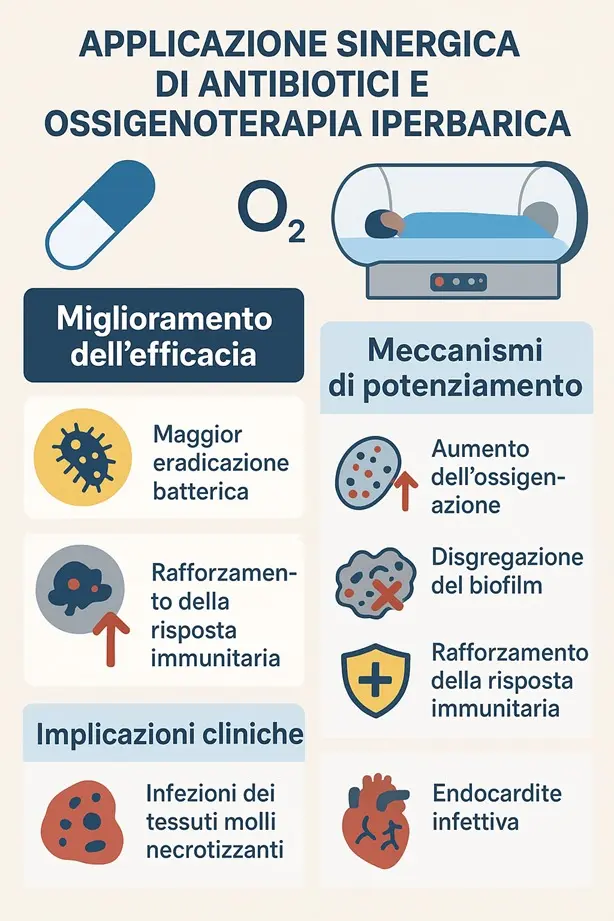
Applicazione sinergica di antibiotici e ossigenoterapia iperbarica (OTI)
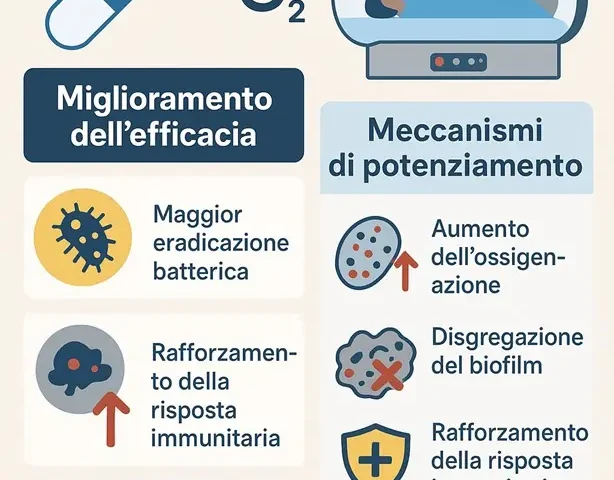
Immagine creata con OpenAI ChatGPT.
https://journals.lww.com/mgar/fulltext/2026/06000/synergistic_application_of_antibiotics_and.14.aspx
Questa interessante pubblicazione disanima sull’uso combinato di antibiotici e ossigenoterapia iperbarica (OTI) come strategia promettente per migliorare l’eradicazione batterica, soprattutto contro ceppi resistenti e infezioni associate a biofilm.
Meccanismi principali di potenziamento
- Aumento dell’ossigenazione: l’OTI amplifica l’attività di antibiotici che sfruttano meccanismi ossigeno-dipendenti. In alcuni casi (ad es. Pseudomonas aeruginosa) la crescita batterica viene completamente inibita a 2.8 ATA. Inoltre, l’ossigeno elevato modifica metabolismo e trascrizione genica dei batteri, influenzando la sensibilità agli antimicrobici.
- Disgregazione del biofilm: l’ossigeno iperbarico penetra più in profondità nei biofilm, compromettendone l’integrità e aumentando l’azione battericida degli antibiotici (es. ciprofloxacina contro P. aeruginosa).
- Rafforzamento della risposta immunitaria: l’OTI migliora l’attività dei neutrofili e la clearance batterica. Tuttavia, la maggiore produzione di specie reattive dell’ossigeno (ROS) potrebbe selezionare ceppi più resistenti.
Adattamenti batterici allo stress ossidativo
I batteri hanno sviluppato sistemi di difesa contro i ROS (catalasi, superossido dismutasi, perossidasi), meccanismi di riparazione del DNA e di risposta allo stress (OxyR, SoxRS). L’esposizione prolungata a ossigeno elevato potrebbe quindi selezionare ceppi con maggiore capacità antiossidante.
Inoltre, la concentrazione di ossigeno influenza l’espressione di porine (OmpF, OmpC), modificando la permeabilità della membrana esterna e la suscettibilità agli antibiotici, in particolare β-lattamici e fluorochinoloni. Tecniche proteomiche avanzate (LC-MS/MS) permettono di analizzare tali variazioni.
Implicazioni cliniche
- Infezioni necrotizzanti dei tessuti molli: una meta-analisi su oltre 49.000 pazienti ha mostrato che l’OTI riduce significativamente la mortalità (RR = 0,522 95% intervallo di confidenza (CI) (0.403, 0.677), P < 0.05) e le complicanze sistemiche come la disfunzione multiorgano , RR = 0.205, 95% CI (0.164,0.256), P < 0.05]. pur richiedendo un maggior numero di debridement. Non sono emerse differenze rilevanti sul tasso di amputazioni.16
- Endocardite infettiva: studi preclinici evidenziano benefici dell’OTI come terapia adiuvante, anche se mancano ancora trial clinici sull’uomo.
Considerazioni finali
L’integrazione di antibiotici e OTI rappresenta una potenziale strategia terapeutica nelle infezioni difficili da trattare. I benefici principali riguardano il potenziamento dell’attività antimicrobica, la disgregazione dei biofilm e il miglioramento della risposta immunitaria. Tuttavia, occorre considerare il rischio di selezione di ceppi più resistenti e la complessità delle risposte batteriche all’ossigeno.
Servono tuttavia ulteriori studi clinici ben strutturati per chiarire i meccanismi molecolari, definire protocolli standardizzati e stabilire il ruolo ottimale dell’OTI in combinazione con le terapie antibiotiche.
Referenze
1. Chmelař D, Rozložník M, Hájek M, Pospíšilová N, Kuzma J. Effect of hyperbaric oxygen on the growth and susceptibility of facultatively anaerobic bacteria and bacteria with oxidative metabolism to selected antibiotics. Folia Microbiol (Praha) 2024;69:101–108.
2. Marzella L, Vezzani G. Effect of hyperbaric oxygen on activity of antibacterial agents. In: Oriani G, Marroni A, Wattel F, eds. Handbook on hyperbaric medicine. Milano: Springer Milan. 1996:699–713.
3. Hind J, Attwell RW. The effect of antibiotics on bacteria under hyperbaric conditions. J Antimicrob Chemother 1996;37:253–263.
4. Bornside GH. Enhancement of antibiotic activity against Staphylococcus aureus by exposure to hyperbaric oxygen. Appl Microbiol 1967;15:1020–1024.
5. Gade PAV, Olsen TB, Jensen PØ, et al. Modelling of ciprofloxacin killing enhanced by hyperbaric oxygen treatment in Pseudomonas aeruginosa PAO1 biofilms. PLoS One 2018;13:e0198909.
6. Kolpen M, Appeldorff CF, Brandt S, et al. Increased bactericidal activity of colistin on Pseudomonas aeruginosa biofilms in anaerobic conditions. Pathog Dis 2016;74:ftv086.
7. Kolpen M, Lerche CJ, Kragh KN, et al. Hyperbaric oxygen sensitizes anoxic pseudomonas aeruginosa biofilm to ciprofloxacin. Antimicrob Agents Chemother 2017;61:e01024–17.
8. Lerche CJ, Schwartz F, Pries-Heje MM, et al. Potential advances of adjunctive hyperbaric oxygen therapy in infective endocarditis. Front Cell Infect Microbiol 2022;12:805964.
9. Imlay JA. Cellular defenses against superoxide and hydrogen peroxide. Annu Rev Biochem 2008;77:755–776.
10. Fang FC. Antimicrobial reactive oxygen and nitrogen species: concepts and controversies. Nat Rev Microbiol 2004;2:820–832.
11. Zheng M, Aslund F, Storz G. Activation of the OxyR transcription factor by reversible disulfide bond formation. Science 1998;279:1718–1721.
12. Dwyer DJ, Belenky PA, Yang JH, et al. Antibiotics induce redox-related physiological alterations as part of their lethality. Proc Natl Acad Sci U S A 2014;111:E2100–2109.
13. Winterbourn CC, Hampton MB. Thiol chemistry and specificity in redox signaling. Free Radic Biol Med 2008;45:549–561.
14. Nikaido H. Molecular basis of bacterial outer membrane permeability revisited. Microbiol Mol Biol Rev 2003;67:593–656.
15. Unden G, Bongaerts J. Alternative respiratory pathways of Escherichia coli: energetic efficiency, and regulation. FEMS Microbiol Rev 1997; 21:143–157.
16. Huang C, Zhong Y, Yue C, He B, Li Y, Li J. The effect of hyperbaric oxygen therapy on the clinical outcomes of necrotizing soft tissue infections: a systematic review and meta-analysis. World J Emerg Surg 2023;18:23.